Suite à un traumatisme de la moelle épinière, la plupart des patients présentent une exagération du tonus musculaire appelée spasticité, qui aboutit souvent à une incapacité motrice. L’équipe « Plasticité et physio-pathologie des réseaux moteurs rythmiques » à l’Institut de neurosciences de la Timone (CNRS/Aix-Marseille Université) vient d’identifier l’un des mécanismes moléculaires responsables de ce phénomène.
Elle a aussi proposé deux solutions thérapeutiques concluantes chez l’animal, dont l’une sera testée en essais cliniques de phase 2 dès cette année. Ces travaux publiés dans la revue le 14 mars 2016 ouvrent donc de nouvelles perspectives pour réduire ce handicap moteur.
12 millions de personnes dans le monde souffrent d’un désordre moteur appelé spasticité. Il apparaît suite à une lésion de la moelle épinière (accident de la route, AVC) ou au cours d’une maladie neurodégénérative comme la sclérose latérale amyotrophique. La spasticité se caractérise principalement par une hyperexcitation des motoneurones, neurones de la moelle épinière qui contrôlent nos contractions musculaires. Cette hyperexcitabilité aboutit à des contractions simultanées et incontrôlées des muscles fléchisseurs et extenseurs, qui rendent tout mouvement locomoteur difficile, voire impossible. Or, les traitements existant aujourd’hui sont peu satisfaisants1.
L’excitation des neurones est en partie déclenchée par les canaux sodiques exprimés sur leur membrane. Leur ouverture génère un flux de sodium qui engendre l’activation brève des motoneurones, à l’origine d’une contraction musculaire de courte durée (figure A1). En cas de spasticité, les flux de sodium durent plus longtemps, ils sont dits « persistants », ce qui entraine une surexcitation du neurone. L’équipe de Frédéric Brocard, à l’Institut de neurosciences de la Timone, a découvert que cette hyperexcitabilité résulte d’une dérégulation des canaux sodiques dans le neurone.
En effet, la fermeture rapide du canal à sodium s’effectue normalement grâce à une « boucle moléculaire » raccordée au canal, qui vient rapidement obstruer celui-ci après son ouverture (figures A2 et A3). Ce processus d’inactivation du canal sodique permet une maîtrise de l’excitabilité du motoneurone. Les chercheurs ont montré que, suite à une lésion de la moelle épinière, l’activité d’une enzyme, la calpaïne, est augmentée. Cette enzyme coupe le canal sodique, ce qui rend inopérant le processus d’inactivation (figure B1). Le pore reste alors ouvert, générant un courant sodique prolongé, de nature persistante (figures B2 et B3).
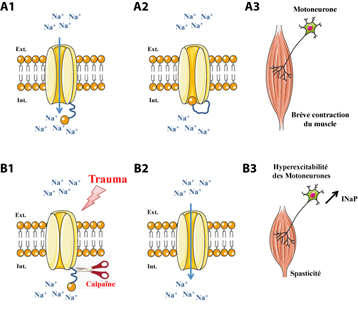
© Frédéric Brocard / Servier Medical Art
Fonctionnement du canal à sodium des motoneurones dans les conditions normales (A) et pathologiques (B).
L’ouverture du canal sodique engendre un courant d’ions sodium Na+ (A1), rapidement stoppé quand une boucle moléculaire de la protéine vient obturer le pore du canal (A2). Ceci engendre une excitation brève du motoneurone, à l’origine d’une contraction musculaire de courte durée (A3). A la suite d’une lésion de la moelle épinière, la calpaïne rend inopérante l’inactivation du canal en coupant la boucle responsable de sa fermeture (B1). Il en résulte un courant sodique persistant, INaP (B2) générant une excitation prolongée du motoneurone, à l’origine d’une contraction soutenue du muscle (B3).
L’équipe de chercheurs a testé deux traitements sur des rats présentant des lésions de la moelle épinière. L’une des molécules est un inhibiteur de la calpaïne. Son utilisation pendant une courte période (dix jours) rétablit le bon fonctionnement du canal sodique et réduit durablement l’ampleur de la spasticité. En effet, un mois après la fin du traitement, les effets positifs sur la spasticité perdurent.
L’autre molécule testée, le riluzole, agit comme un inhibiteur du courant sodique persistant. Elle réduit également la spasticité, même si ses effets restent temporaires dans la mesure où celle-ci réapparaît deux semaines après la fin du traitement. La molécule présente pourtant un grand intérêt puisqu’elle est déjà administrable aux patients atteints de sclérose latérale amyotrophique. Des essais cliniques de phase 2, qui débuteront cette année à l’hôpital de la Timone, testeront son efficacité dans le traitement de la spasticité chez des patients atteints de lésions de la moelle épinière. En parallèle, l’équipe de Frédéric Brocard continuera à décrypter le phénomène de spasticité – plus spécifiquement l’implication de la calpaïne dans la dérégulation des motoneurones – et tester d’autres inhibiteurs de cette enzyme administrables à l’homme.
Bibliographie
Calpain-mediated proteolytic cleavage of sodium channels after spinal cord injury increases the persistent sodium current and contributes to spasticity, Cécile Brocard, Vanessa Plantier, Pascale Boulenguez, Sylvie Liabeuf, Mouloud Bouhadfane, Annelise Viallat-Lieutaud, Laurent Vinay & Frédéric Brocard. Nature Medicine, 14 mars 2016. DOI: 10.1038/NM.4061